Điều chế khí oxi là một phần quan trọng trong chương trình Hóa học 8, cụ thể là trong Giải Sbt Hóa 8 Bài 27. Bài viết này sẽ giúp bạn hiểu rõ hơn về phương pháp điều chế khí oxi, phản ứng phân hủy, và những kiến thức liên quan.
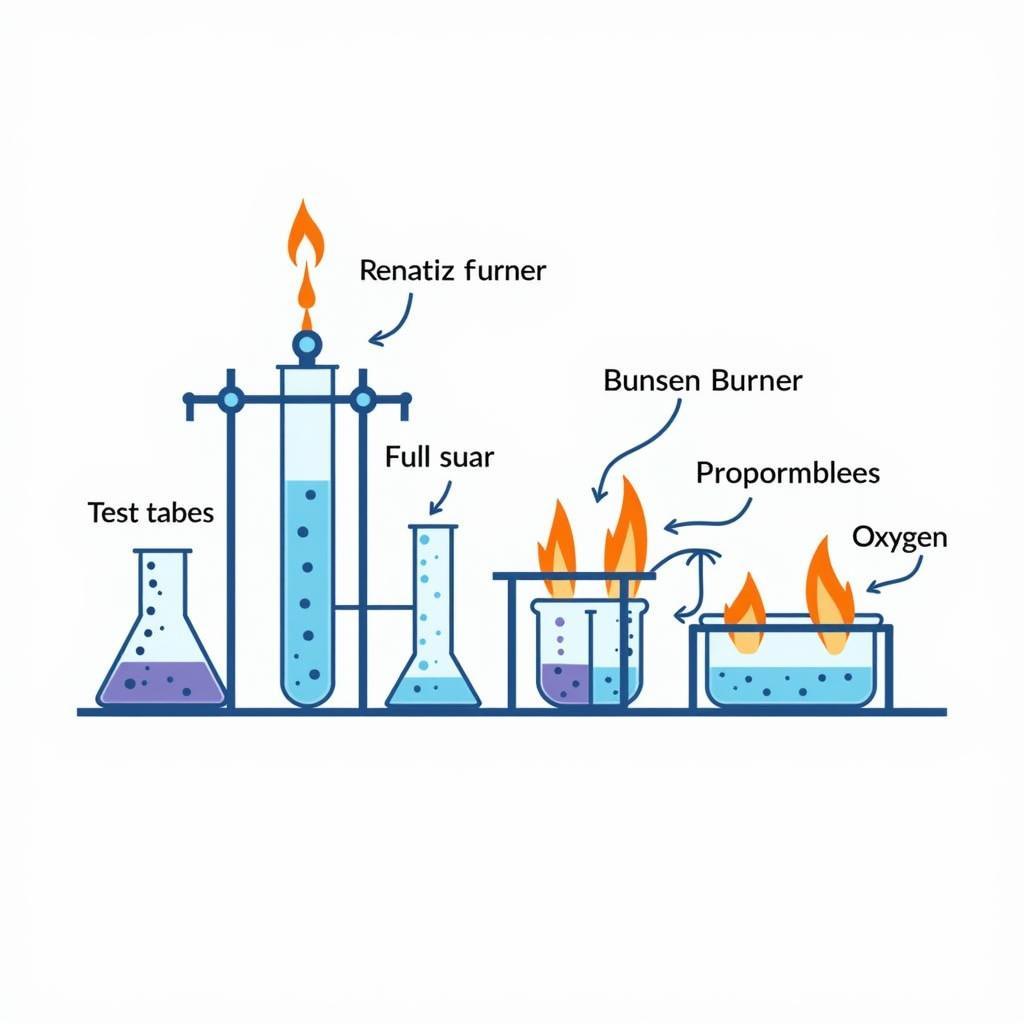 Điều chế khí oxi trong phòng thí nghiệm
Điều chế khí oxi trong phòng thí nghiệm
Phản ứng phân hủy là một loại phản ứng hóa học, trong đó một chất bị phân hủy thành hai hay nhiều chất khác nhau. Đây là phương pháp thường được sử dụng để điều chế khí oxi trong phòng thí nghiệm. Một số chất thường được sử dụng để điều chế oxi là Kali pemanganat (KMnO4) và Kali clorat (KClO3).
Điều Chế Khí Oxi từ KMnO4
Khi đun nóng Kali pemanganat (KMnO4), chất này sẽ phân hủy thành Kali manganat (K2MnO4), Mangan đioxit (MnO2) và khí oxi (O2). Phương trình hóa học của phản ứng như sau:
2KMnO4 → K2MnO4 + MnO2 + O2
Điều Chế Khí Oxi từ KClO3
Kali clorat (KClO3) cũng có thể được sử dụng để điều chế khí oxi. Khi đun nóng KClO3 với chất xúc tác Mangan đioxit (MnO2), phản ứng phân hủy xảy ra tạo thành Kali clorua (KCl) và khí oxi (O2). Phương trình hóa học:
2KClO3 → 2KCl + 3O2
So Sánh Hai Phương Pháp Điều Chế Oxi
Cả hai phương pháp đều có ưu và nhược điểm riêng. Sử dụng KMnO4 đơn giản hơn, không cần chất xúc tác, nhưng lượng oxi thu được ít hơn. Sử dụng KClO3 cần chất xúc tác MnO2 nhưng cho lượng oxi thu được nhiều hơn.
Thu Khí Oxi
Khí oxi được thu bằng phương pháp đẩy nước hoặc đẩy không khí. Phương pháp đẩy nước được sử dụng phổ biến hơn do oxi ít tan trong nước.
Trích dẫn từ chuyên gia Nguyễn Văn A, giảng viên Hóa học tại Đại học Bách Khoa Hà Nội: “Việc nắm vững kiến thức về điều chế khí oxi là nền tảng quan trọng cho việc học tập các bài học tiếp theo trong chương trình Hóa học 8.”
Tại sao cần đun nóng để phân hủy KMnO4 và KClO3?
Nhiệt độ cao cung cấp năng lượng cần thiết để phá vỡ liên kết hóa học trong KMnO4 và KClO3, tạo điều kiện cho phản ứng phân hủy xảy ra.
Trích dẫn từ chuyên gia Trần Thị B, giáo viên Hóa học tại trường THPT Chuyên Hà Nội – Amsterdam: “Hiểu rõ bản chất của phản ứng phân hủy sẽ giúp học sinh dễ dàng tiếp cận các kiến thức phức tạp hơn về hóa học.”
 Thu khí oxi bằng phương pháp đẩy nước
Thu khí oxi bằng phương pháp đẩy nước
Kết luận
Giải SBT Hóa 8 bài 27 giúp học sinh hiểu rõ về điều chế khí oxi, phản ứng phân hủy và các phương pháp thu khí. Nắm vững kiến thức này là bước đệm quan trọng để học tốt môn Hóa học.
FAQ
- Phản ứng phân hủy là gì?
- Tại sao KMnO4 và KClO3 được sử dụng để điều chế oxi?
- Chất xúc tác trong phản ứng phân hủy KClO3 là gì?
- Có những phương pháp nào để thu khí oxi?
- Tại sao cần đun nóng KMnO4 và KClO3 để điều chế oxi?
- Ưu điểm và nhược điểm của từng phương pháp điều chế oxi là gì?
- Làm thế nào để nhận biết khí oxi?
Mô tả các tình huống thường gặp câu hỏi.
Học sinh thường gặp khó khăn trong việc viết phương trình phản ứng phân hủy và phân biệt giữa phương pháp đẩy nước và đẩy không khí khi thu khí.
Gợi ý các câu hỏi khác, bài viết khác có trong web.
Bạn có thể tìm hiểu thêm về các phản ứng hóa học khác tại gg giải toán.
Khi cần hỗ trợ hãy liên hệ Số Điện Thoại: 02033846993, Email: [email protected] Hoặc đến địa chỉ: X2FW+GGM, Cái Lân, Bãi Cháy, Hạ Long, Quảng Ninh, Việt Nam. Chúng tôi có đội ngũ chăm sóc khách hàng 24/7.
