Hóa học 10 chương 3 là một chương học quan trọng, cung cấp kiến thức nền về liên kết hóa học và cấu trúc phân tử. Để giúp các bạn học sinh nắm vững nội dung bài học và đạt kết quả cao trong các kỳ thi, bài viết này sẽ cung cấp lời giải chi tiết cho các bài tập hóa 10 chương 3.
Tại Sao Cần Giải Bài Tập Hóa 10 Chương 3?
Việc giải bài tập hóa 10 chương 3 có ý nghĩa quan trọng đối với việc học tập của học sinh bởi vì:
- Củng cố kiến thức: Giúp học sinh ôn tập lại các khái niệm, định luật, nguyên lý đã học trong chương 3 như liên kết ion, liên kết cộng hóa trị, cấu trúc phân tử,…
- Rèn luyện kỹ năng: Phát triển kỹ năng giải bài tập, vận dụng kiến thức đã học vào thực tế, phân tích và giải quyết vấn đề một cách logic.
- Nâng cao tư duy: Giúp học sinh rèn luyện tư duy logic, tư duy phản biện, khả năng phân tích và tổng hợp thông tin.
- Chuẩn bị cho các kỳ thi: Giải bài tập thường xuyên là cách tốt nhất để học sinh ôn tập và chuẩn bị cho các kỳ thi, kiểm tra.
Lời Giải Chi Tiết Bài Tập Hóa 10 Chương 3
Phần này sẽ cung cấp lời giải chi tiết cho một số bài tập tiêu biểu trong sách giáo khoa Hóa học 10, chương 3.
Bài Tập Về Liên Kết Ion
Bài 1: Viết công thức electron và công thức Lewis của các hợp chất ion sau:
a) NaCl
b) MgO
c) CaCl2
Lời giải:
a) NaCl
-
Công thức electron:
-
Công thức Lewis:
b) MgO
-
Công thức electron:
-
Công thức Lewis:
c) CaCl2
- Công thức electron:
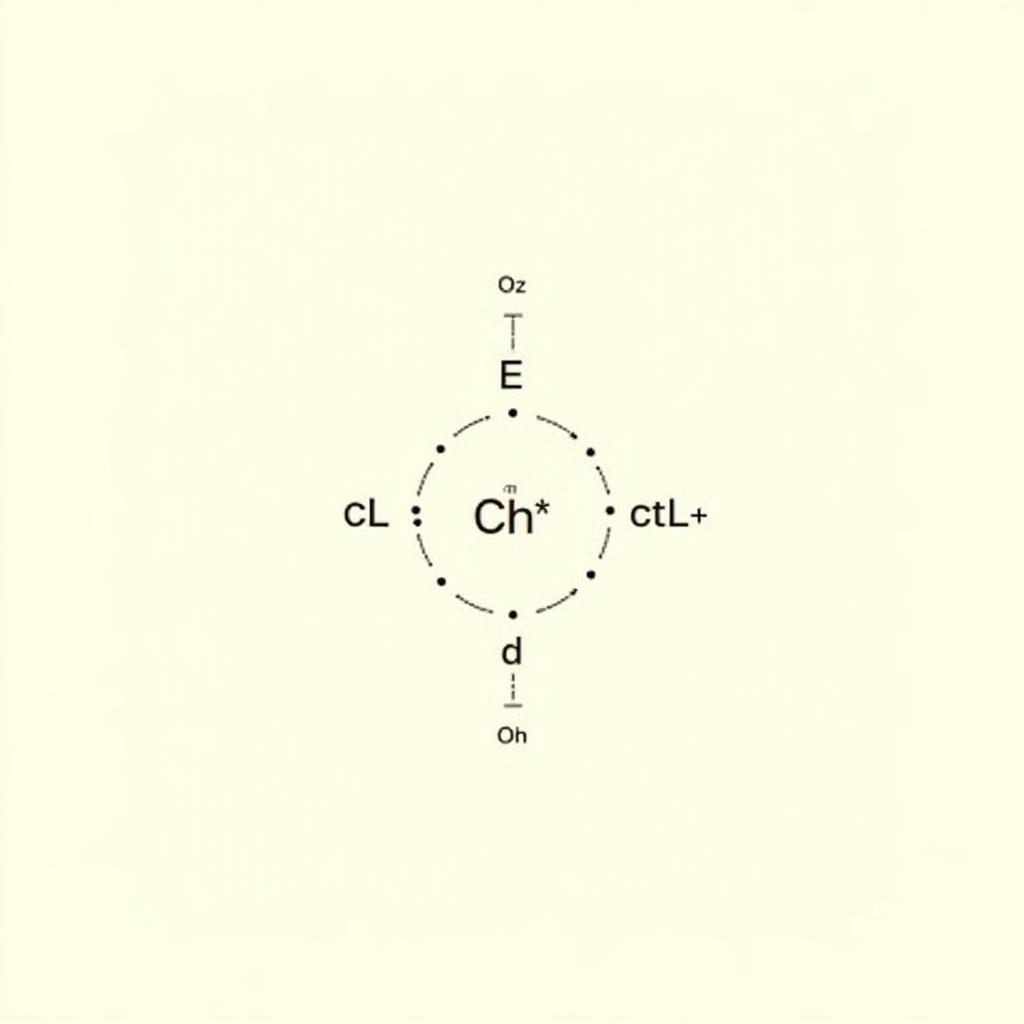 Công thức electron của CaCl2
Công thức electron của CaCl2 - Công thức Lewis:
Bài Tập Về Liên Kết Cộng Hóa Trị
Bài 2: Viết công thức electron, công thức Lewis và xác định loại liên kết trong các phân tử sau:
a) H2
b) Cl2
c) HCl
Lời giải:
a) H2
- Công thức electron:
- Công thức Lewis: H:H
- Loại liên kết: Liên kết cộng hóa trị không phân cực
b) Cl2
- Công thức electron:
- Công thức Lewis: Cl:Cl
- Loại liên kết: Liên kết cộng hóa trị không phân cực
c) HCl
- Công thức electron:
- Công thức Lewis: H:Cl
- Loại liên kết: Liên kết cộng hóa trị có cực
Bài Tập Về Cấu Trúc Phân Tử
Bài 3: Xác định dạng hình học của các phân tử sau theo mô hình VSEPR:
a) BeCl2
b) BF3
c) CH4
Lời giải:
a) BeCl2
- Số electron lớp ngoài cùng của Be: 2
- Số cặp electron chung quanh Be: 2
- Số cặp electron tự do trên Be: 0
- Theo mô hình VSEPR, BeCl2 có dạng hình học tuyến tính.
b) BF3
- Số electron lớp ngoài cùng của B: 3
- Số cặp electron chung quanh B: 3
- Số cặp electron tự do trên B: 0
- Theo mô hình VSEPR, BF3 có dạng hình học tam giác phẳng.
c) CH4
- Số electron lớp ngoài cùng của C: 4
- Số cặp electron chung quanh C: 4
- Số cặp electron tự do trên C: 0
- Theo mô hình VSEPR, CH4 có dạng hình học tứ diện đều.
Mẹo Học Tốt Hóa 10 Chương 3
Để học tốt hóa học 10 chương 3, học sinh có thể áp dụng một số mẹo sau:
- Nắm vững lý thuyết: Đọc kỹ sách giáo khoa, ghi nhớ các khái niệm, định luật, nguyên lý cơ bản của chương.
- Luyện tập thường xuyên: Giải nhiều bài tập từ dễ đến khó, từ cơ bản đến nâng cao.
- Học nhóm hiệu quả: Tham gia học nhóm để trao đổi kiến thức, cùng nhau giải bài tập và giúp đỡ lẫn nhau trong quá trình học.
- Tìm kiếm sự hỗ trợ: Khi gặp khó khăn, hãy hỏi giáo viên, bạn bè hoặc tham khảo các tài liệu tham khảo khác.
Ngoài ra, bạn có thể tham khảo thêm các bài viết liên quan trên website Giải Bóng như:
Kết Luận
Bài viết đã cung cấp lời giải chi tiết cho một số bài tập hóa 10 chương 3, hy vọng sẽ giúp các bạn học sinh nắm vững kiến thức và đạt kết quả cao trong học tập. Chúc các bạn thành công!
FAQ
1. Làm thế nào để xác định được loại liên kết hóa học trong phân tử?
Trả lời: Để xác định loại liên kết hóa học trong phân tử, ta dựa vào hiệu độ âm điện của 2 nguyên tử.
- Nếu hiệu độ âm điện ≥ 1,7: Liên kết ion.
- Nếu hiệu độ âm điện từ 0,4 – 1,7: Liên kết cộng hóa trị có cực.
- Nếu hiệu độ âm điện < 0,4: Liên kết cộng hóa trị không cực.
2. Mô hình VSEPR là gì?
Trả lời: Mô hình VSEPR (Valence Shell Electron Pair Repulsion – Mô hình đẩy electron lớp vỏ hóa trị) là mô hình được sử dụng để dự đoán hình dạng của phân tử hoặc ion dựa trên số cặp electron lớp vỏ hóa trị xung quanh nguyên tử trung tâm.
3. Làm thế nào để học tốt phần liên kết hóa học?
Trả lời: Để học tốt phần liên kết hóa học, học sinh cần:
- Nắm vững các khái niệm về liên kết ion, liên kết cộng hóa trị, các loại liên kết, quy tắc octet,…
- Vẽ được công thức electron, công thức Lewis của các phân tử, ion đơn giản.
- Xác định được dạng hình học của phân tử dựa vào mô hình VSEPR.
- Luyện tập giải nhiều bài tập.
Bạn cần hỗ trợ?
Liên hệ ngay với chúng tôi:
- Số Điện Thoại: 02033846993
- Email: [email protected]
- Địa chỉ: X2FW+GGM, Cái Lân, Bãi Cháy, Hạ Long, Quảng Ninh, Việt Nam.
Chúng tôi có đội ngũ chăm sóc khách hàng 24/7.
