Bài 27 về nhôm trong SGK Hóa học là một phần quan trọng giúp học sinh hiểu về tính chất và ứng dụng của kim loại này. Bài viết này sẽ hướng dẫn chi tiết cách giải các bài tập SGK liên quan đến bài 27 nhôm, đồng thời cung cấp kiến thức chuyên sâu về nhôm để bạn đọc nắm vững nội dung bài học. Ngay sau đây, chúng ta sẽ cùng nhau khám phá thế giới của nhôm và các bài tập liên quan.
Tính Chất Vật Lý và Hóa Học của Nhôm
Nhôm là kim loại màu trắng bạc, có khối lượng riêng nhỏ và dễ dát mỏng. Tính chất hóa học đặc trưng của nhôm là tính khử mạnh. Nhôm tác dụng với oxi, axit, dung dịch kiềm và một số muối. Việc hiểu rõ các tính chất này là nền tảng để giải quyết các bài tập SGK. bài tập hóa 11 chương 1 có lời giải có thể giúp bạn củng cố kiến thức về tính chất hóa học của kim loại nói chung.
Phản ứng của Nhôm với Oxi
Khi đốt nóng, nhôm phản ứng mạnh với oxi tạo thành nhôm oxit (Al2O3). Lớp oxit này bảo vệ nhôm khỏi bị ăn mòn.
 Phản ứng của nhôm với oxi
Phản ứng của nhôm với oxi
Phản ứng của Nhôm với Axit
Nhôm phản ứng với axit mạnh như HCl, H2SO4 loãng tạo thành muối nhôm và giải phóng khí hiđro.
Phản ứng của Nhôm với Dung Dịch Kiềm
Nhôm tan trong dung dịch kiềm mạnh như NaOH, KOH tạo thành aluminat và giải phóng khí hiđro. Đặc điểm này phân biệt nhôm với nhiều kim loại khác. Cần lưu ý, nhôm không phản ứng với HNO3 và H2SO4 đặc nguội. giải bài tập hóa 9 bài 9 trang 33 cung cấp thêm thông tin về phản ứng của kim loại với axit.
Hướng Dẫn Giải Bài Tập SGK Bài 27 Nhôm
Để giải bài tập SGK bài 27 nhôm hiệu quả, cần nắm vững các phương trình phản ứng hóa học đặc trưng của nhôm. Dưới đây là một số ví dụ minh họa.
Ví dụ 1: Tính khối lượng nhôm cần dùng để điều chế 10,2 gam nhôm oxit.
- Bước 1: Viết phương trình phản ứng: 4Al + 3O2 → 2Al2O3
- Bước 2: Tính số mol Al2O3: n(Al2O3) = m/M = 10,2/102 = 0,1 mol
- Bước 3: Tính số mol Al dựa vào tỉ lệ mol trong phương trình: n(Al) = 2*n(Al2O3) = 0,2 mol
- Bước 4: Tính khối lượng Al: m(Al) = nM = 0,227 = 5,4 gam
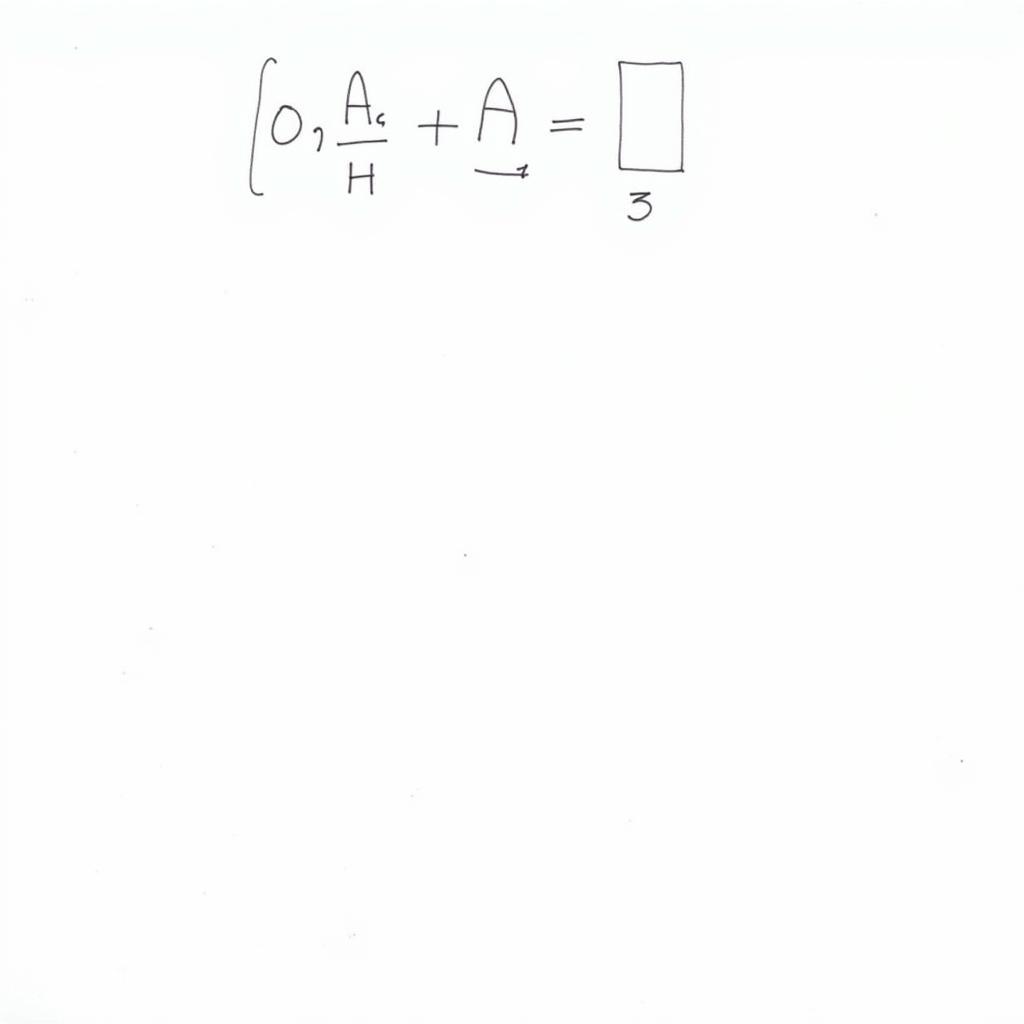 Giải bài tập nhôm oxit
Giải bài tập nhôm oxit
Ví dụ 2: Nhôm phản ứng với dung dịch HCl. Viết phương trình phản ứng và xác định chất nào là chất khử, chất nào là chất oxi hóa.
- Phương trình phản ứng: 2Al + 6HCl → 2AlCl3 + 3H2
- Al là chất khử (cho electron), H+ trong HCl là chất oxi hóa (nhận electron). bài 6 trang 84 sgk hóa 8 lời giải hay sẽ giúp bạn hiểu rõ hơn về phản ứng oxi hóa khử.
Ứng Dụng của Nhôm
Nhôm được sử dụng rộng rãi trong đời sống và công nghiệp nhờ tính chất nhẹ, bền và dễ gia công. Nhôm được dùng để chế tạo vỏ máy bay, ô tô, cửa sổ, đồ gia dụng… giải thích ký hiệu vật liệu cơ khí có thể cung cấp thêm thông tin về ứng dụng của nhôm trong cơ khí.
 Ứng dụng của nhôm
Ứng dụng của nhôm
Kết luận
Bài 27 Nhôm Giải Bài Tập Sgk là một chủ đề quan trọng trong chương trình Hóa học. Việc nắm vững tính chất và các phương trình phản ứng của nhôm sẽ giúp học sinh giải quyết các bài tập một cách hiệu quả. Hiểu về nhôm cũng giúp chúng ta thấy được tầm quan trọng của kim loại này trong đời sống.
FAQ
- Tại sao nhôm không bị gỉ?
- Nhôm có phản ứng với nước không?
- Nhôm được sản xuất như thế nào?
- Tại sao nhôm được sử dụng rộng rãi trong công nghiệp?
- Nhôm có độc hại không?
- Nhôm có thể tái chế được không?
- Sự khác nhau giữa nhôm và hợp kim nhôm là gì?
Mô tả các tình huống thường gặp câu hỏi.
Học sinh thường gặp khó khăn trong việc cân bằng phương trình phản ứng của nhôm, đặc biệt là phản ứng với dung dịch kiềm. Ngoài ra, việc áp dụng các kiến thức lý thuyết vào giải bài tập tính toán cũng là một thử thách.
Gợi ý các câu hỏi khác, bài viết khác có trong web.
Bạn có thể tìm hiểu thêm về các kim loại khác như sắt, đồng tại website Giải Bóng. giải pháp cải tạo đất phèn là một bài viết khác có thể bạn quan tâm.
