Ôn tập chương 1 cấu tạo nguyên tử trong Giải Hóa Lớp 10 Bài 10 giúp học sinh củng cố kiến thức về nguyên tử, hạt nhân nguyên tử, electron và các loại liên kết hóa học. Bài viết này sẽ giúp bạn nắm vững những điểm quan trọng của chương 1, từ đó chuẩn bị tốt cho các bài học tiếp theo.
Hạt Nhân Nguyên Tử và Electron
Hạt nhân nguyên tử chứa proton mang điện tích dương và neutron không mang điện. Số proton (ký hiệu là Z) quyết định nguyên tố hóa học. Electron mang điện tích âm, chuyển động xung quanh hạt nhân. Số electron bằng số proton trong nguyên tử trung hòa về điện. Sự sắp xếp electron theo lớp và phân lớp quyết định tính chất hóa học của nguyên tố. Giải hóa lớp 10 bài 10 tổng hợp lại kiến thức quan trọng này, giúp học sinh dễ dàng ghi nhớ.
Sự khác nhau về số neutron tạo ra các đồng vị của cùng một nguyên tố. Ví dụ, hydro có ba đồng vị: protium (không có neutron), deuterium (một neutron) và tritium (hai neutron). Khối lượng nguyên tử được tính bằng tổng số proton và neutron.
 Cấu tạo nguyên tử
Cấu tạo nguyên tử
Các Loại Liên Kết Hóa Học
Nguyên tử liên kết với nhau để tạo thành phân tử và hợp chất. Giải hóa lớp 10 bài 10 đề cập đến ba loại liên kết chính: liên kết ion, liên kết cộng hóa trị và liên kết kim loại. Liên kết ion hình thành giữa kim loại và phi kim, do sự cho và nhận electron. Ví dụ, natri (Na) cho một electron cho clo (Cl) để tạo thành NaCl. Liên kết cộng hóa trị hình thành khi các nguyên tử chia sẻ electron. Ví dụ, hai nguyên tử hydro chia sẻ electron để tạo thành phân tử H2.
Liên kết kim loại hình thành giữa các nguyên tử kim loại, do sự di chuyển tự do của electron trong mạng tinh thể kim loại. Tính chất của các chất phụ thuộc vào loại liên kết giữa các nguyên tử. Ví dụ, chất có liên kết ion thường có điểm nóng chảy cao và dẫn điện tốt khi nóng chảy hoặc hòa tan trong nước.
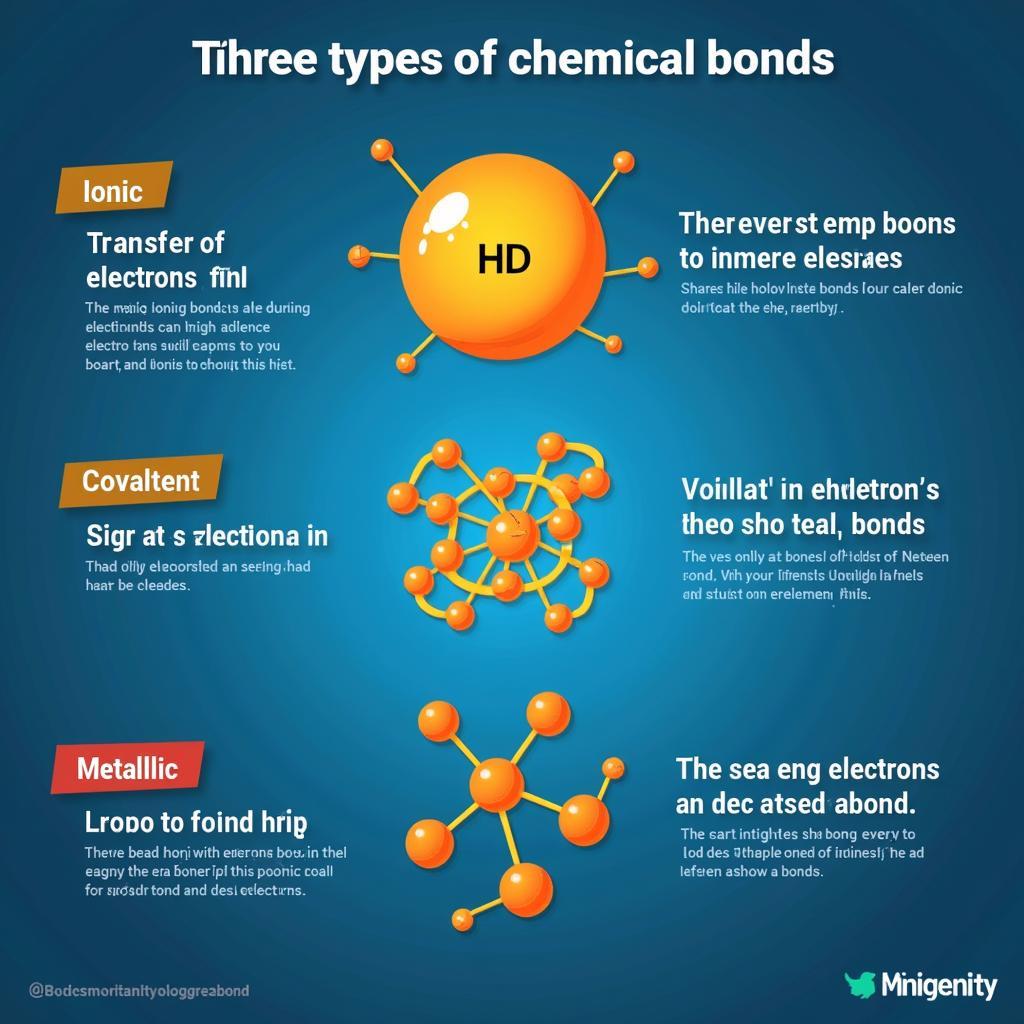 Các loại liên kết hóa học
Các loại liên kết hóa học
Ôn Tập Giải Hóa Lớp 10 Bài 10: Câu Hỏi Thường Gặp
Giải hóa lớp 10 bài 10 bao gồm nhiều dạng bài tập, giúp học sinh rèn luyện kỹ năng giải quyết các vấn đề liên quan đến cấu tạo nguyên tử. Dưới đây là một số câu hỏi thường gặp:
- Làm thế nào để xác định số proton, neutron và electron trong một nguyên tử?
- Sự khác nhau giữa đồng vị là gì?
- Phân biệt ba loại liên kết hóa học.
- Cách viết công thức electron và công thức cấu tạo của phân tử.
Kết Luận
Giải hóa lớp 10 bài 10 ôn tập chương 1 cấu tạo nguyên tử cung cấp kiến thức nền tảng quan trọng cho việc học hóa học. Nắm vững các khái niệm về nguyên tử, liên kết hóa học, và các loại liên kết sẽ giúp bạn hiểu sâu hơn về tính chất của các chất và các phản ứng hóa học.
 Ôn tập giải hóa lớp 10 bài 10
Ôn tập giải hóa lớp 10 bài 10
FAQ
- Tại sao việc hiểu cấu tạo nguyên tử lại quan trọng?
- Số electron tối đa trên mỗi lớp electron là bao nhiêu?
- Làm thế nào để phân biệt liên kết ion và liên kết cộng hóa trị?
- Liên kết kim loại có những tính chất đặc trưng nào?
- Ứng dụng của đồng vị trong đời sống là gì?
- Làm thế nào để xác định cấu hình electron của một nguyên tử?
- Nguyên tắc sắp xếp electron vào các lớp và phân lớp là gì?
Tình huống thường gặp câu hỏi
Học sinh thường gặp khó khăn trong việc phân biệt các loại liên kết hóa học và viết công thức cấu tạo của phân tử. Việc luyện tập nhiều bài tập và tham khảo các tài liệu giải hóa sẽ giúp khắc phục những khó khăn này.
Gợi ý các câu hỏi khác, bài viết khác có trong web.
Bạn có thể tìm hiểu thêm về giải bóng đá U23 châu Á trên website của chúng tôi.
