Điện hóa học, một lĩnh vực quan trọng của hóa học, nghiên cứu mối liên hệ giữa phản ứng hóa học và dòng điện. Bài tập điện hóa lí là phần không thể thiếu giúp học sinh ôn tập và củng cố kiến thức. Bài viết này cung cấp những dạng bài tập điện hóa lí phổ biến có lời giải chi tiết, giúp bạn tự tin chinh phục mọi kỳ thi.
Các Dạng Bài Tập Điện Hóa Lí Thường Gặp
1. Xác Định Cực Anot, Catot và Viết Nửa Phản Ứng Điện Hóa
Dạng bài tập: Cho một pin điện hóa gồm hai điện cực và dung dịch điện li. Yêu cầu xác định cực anot, catot và viết nửa phản ứng xảy ra tại mỗi điện cực.
Phương pháp giải:
- Bước 1: Xác định cặp oxi hóa – khử mạnh hơn trong hai điện cực dựa vào dãy điện hóa.
- Bước 2: Điện cực có cặp oxi hóa – khử mạnh hơn là catot (xảy ra phản ứng khử), điện cực còn lại là anot (xảy ra phản ứng oxi hóa).
- Bước 3: Cân bằng điện tích và số electron cho mỗi nửa phản ứng.
Ví dụ: Cho pin điện hóa Zn-Cu.
Lời giải:
- Zn có tính khử mạnh hơn Cu (dựa vào dãy điện hóa).
- Zn là anot (-), Cu là catot (+).
- Nửa phản ứng:
- Anot (-): Zn → Zn2+ + 2e
- Catot (+): Cu2+ + 2e → Cu
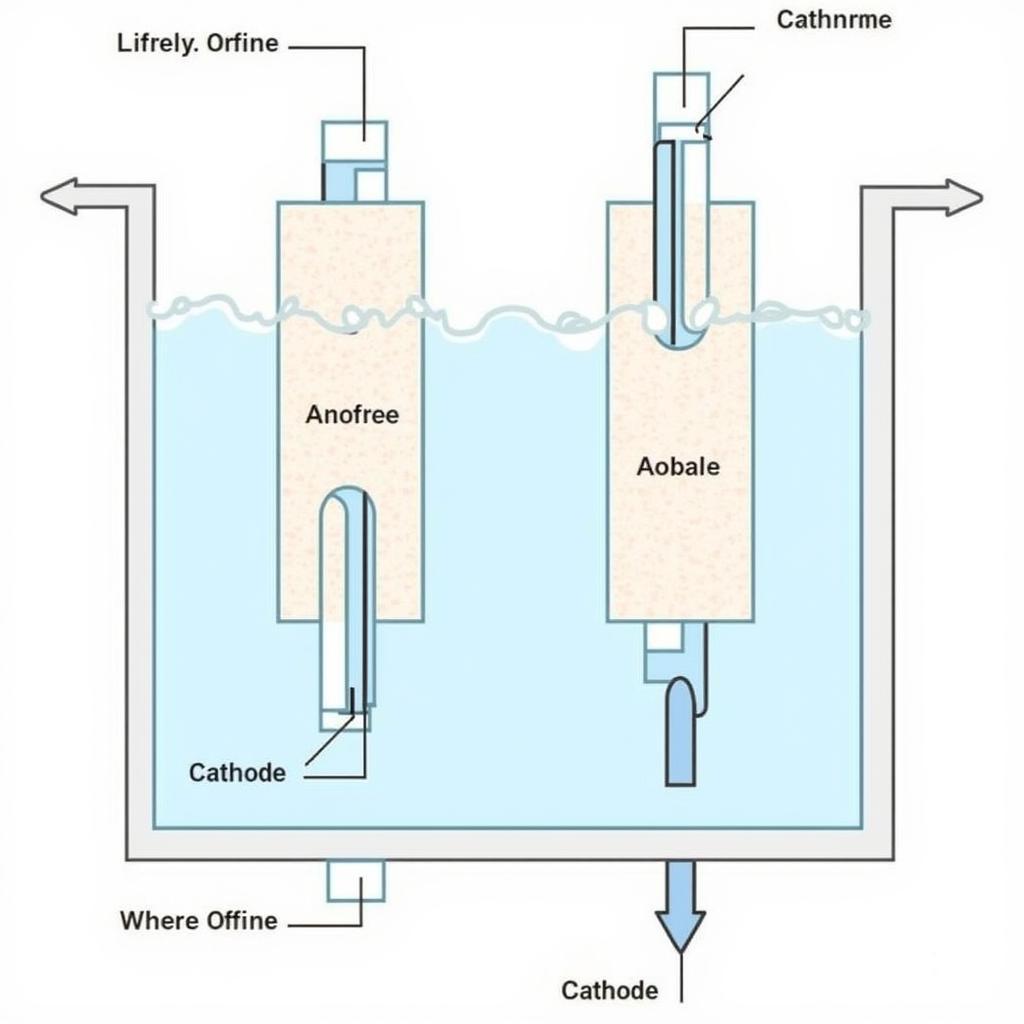 Xác định cực anot và catot
Xác định cực anot và catot
2. Tính Suất Điện Động Của Pin Điện Hóa
Dạng bài tập: Cho biết giá trị E0 của các cặp oxi hóa – khử. Yêu cầu tính suất điện động (E) của pin điện hóa.
Công thức: Epin = Ecatot – Eanot
Lưu ý:
- E0 là giá trị điện thế chuẩn của cặp oxi hóa – khử.
- Epin luôn dương.
Ví dụ: Tính suất điện động chuẩn của pin điện hóa Zn-Cu, biết:
- E0(Zn2+/Zn) = -0.76V
- E0(Cu2+/Cu) = +0.34V
Lời giải:
- Epin = E0(Cu2+/Cu) – E0(Zn2+/Zn) = +0.34 – (-0.76) = +1.1V
3. Ứng Dụng Định Luật Faraday Trong Điện Phân
Dạng bài tập: Cho biết cường độ dòng điện, thời gian điện phân và khối lượng mol của chất được giải phóng. Yêu cầu tính khối lượng chất thu được ở điện cực.
Công thức: m = (A.I.t) / (n.F)
Trong đó:
- m: Khối lượng chất thu được (gam).
- A: Khối lượng mol của chất (g/mol).
- I: Cường độ dòng điện (A).
- t: Thời gian điện phân (giây).
- n: Số electron trao đổi trong phản ứng điện phân.
- F: Hằng số Faraday (96500 C/mol).
Ví dụ: Điện phân dung dịch CuSO4 với cường độ dòng điện 2A trong 30 phút. Tính khối lượng đồng bám trên catot.
Lời giải:
-
A(Cu) = 64 g/mol
-
I = 2A
-
t = 30 x 60 = 1800 giây
-
n = 2 (Cu2+ + 2e → Cu)
-
m(Cu) = (64 x 2 x 1800) / (2 x 96500) ≈ 1.19 gam
 Ứng dụng định luật Faraday trong điện phân
Ứng dụng định luật Faraday trong điện phân
Kết Luận
Bài tập điện hóa lí là phần quan trọng giúp bạn nắm vững kiến thức và vận dụng vào thực tế. Hy vọng bài viết này đã cung cấp cho bạn những kiến thức bổ ích về các dạng Bài Tập điện Hóa Lí Có Lời Giải chi tiết.
Bạn muốn tìm hiểu thêm về bồi dưỡng tham gia phiên hòa giải luật sư? Truy cập ngay website của chúng tôi!
Câu hỏi thường gặp
- Sự khác nhau giữa pin điện hóa và bình điện phân là gì?
- Làm thế nào để xác định chiều dòng điện trong pin điện hóa?
- Vai trò của cầu muối trong pin điện hóa là gì?
- Ứng dụng của điện phân trong đời sống là gì?
- Làm cách nào để tính hiệu suất của quá trình điện phân?
Bạn cần hỗ trợ?
Liên hệ ngay:
- Số điện thoại: 02033846993
- Email: [email protected]
- Địa chỉ: X2FW+GGM, Cái Lân, Bãi Cháy, Hạ Long, Quảng Ninh, Việt Nam.
Chúng tôi luôn sẵn sàng hỗ trợ bạn 24/7!
